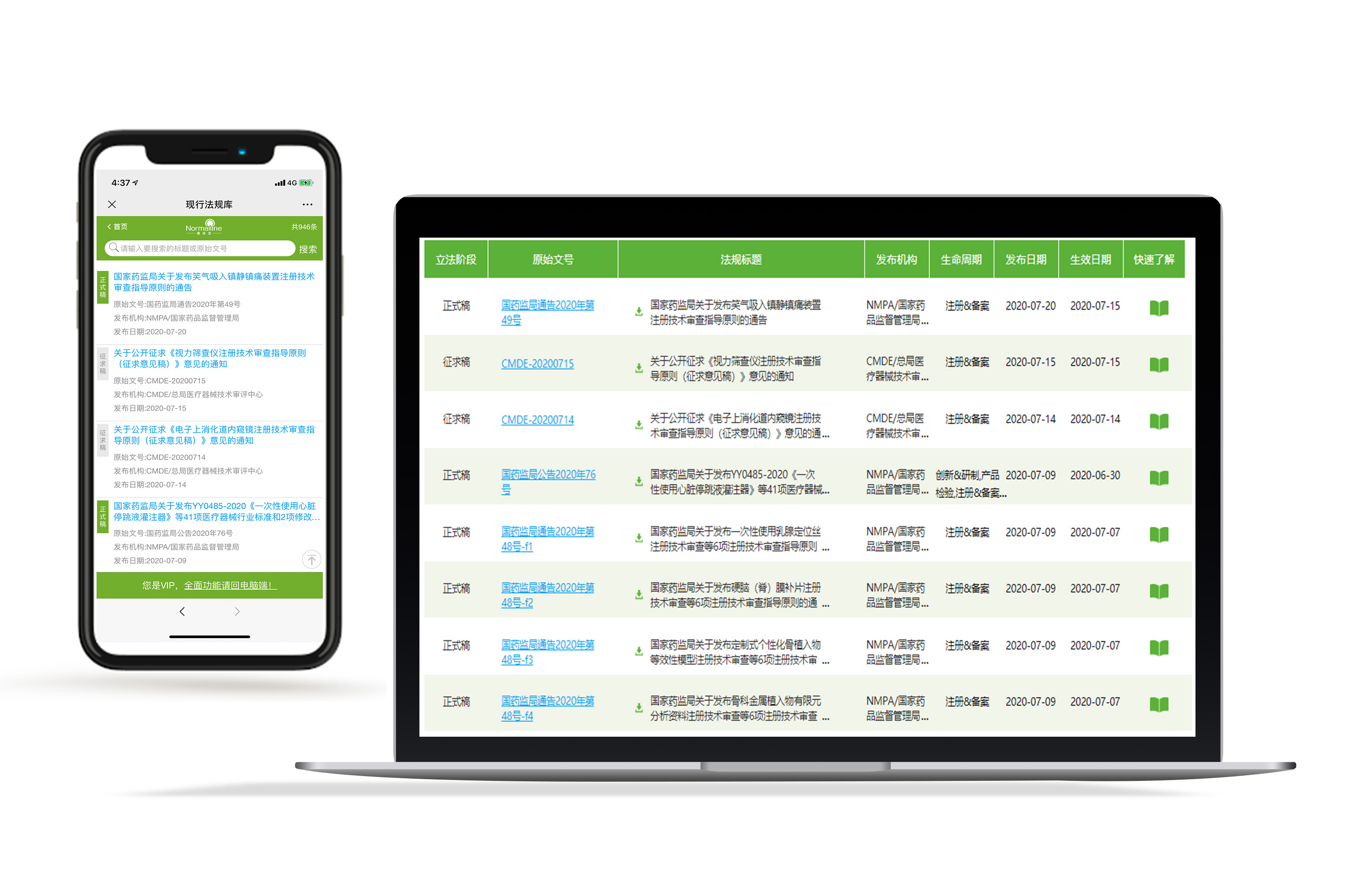
现行法规汇总
权威信息,实时更新,精准解读,一键下载
合规宝介绍及购买
如何自如享用全站所有资源,各种实用工具
问答中心
700+合规高频问题,审评员及资深专家已给出答案
直播课堂
这里是你百忙中的一个充电小角落
明确产品分类
分类决定了产品注册上市、临床路径,必须百分百确定。合规宝现已收录10000+数据(器械+试剂),汇聚所有已公布分类。推荐使用器械分类目录,试剂分类目录,目录外产品界定汇总。
首次、延续、变更注册申报
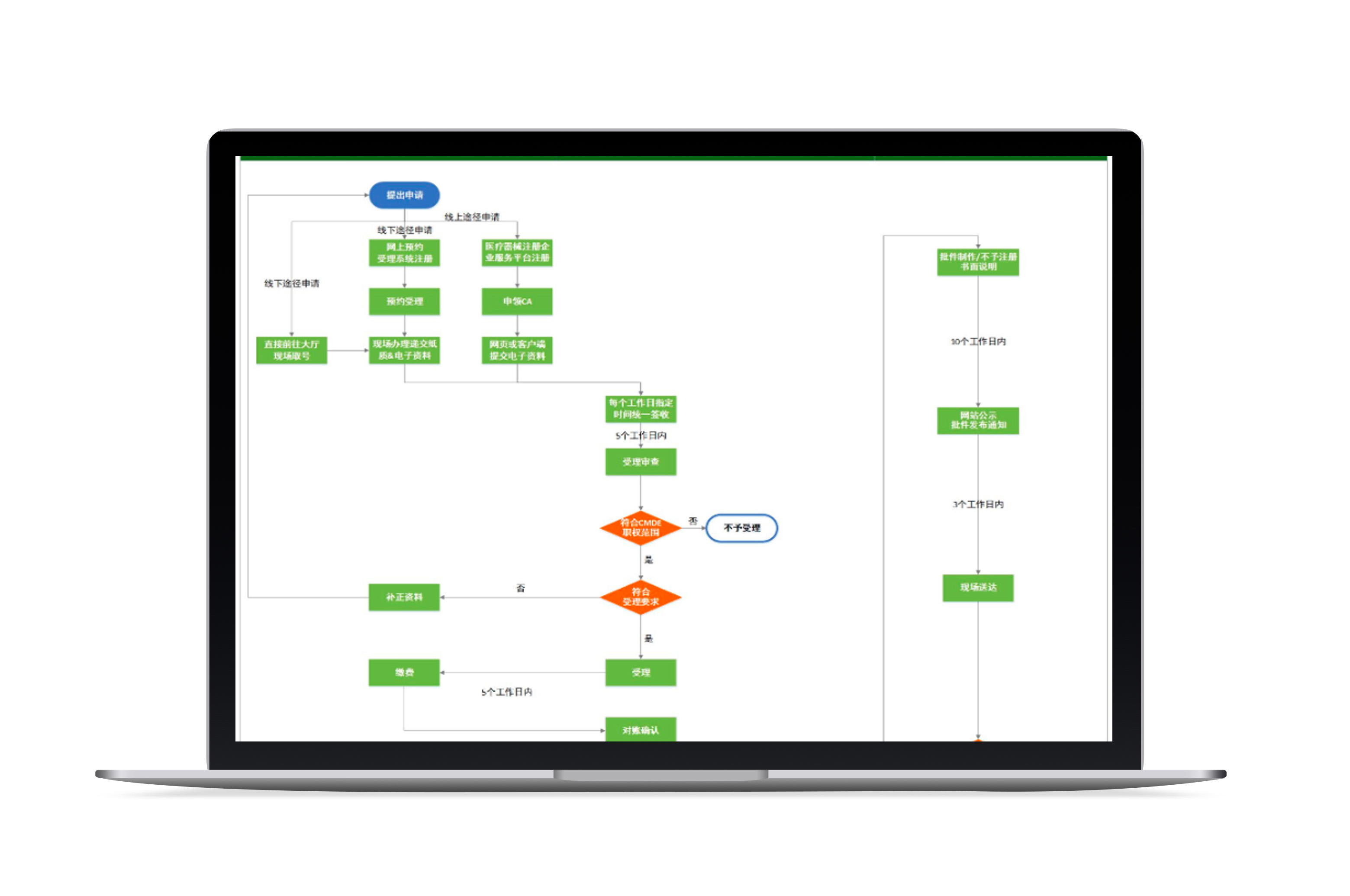
注册证是企业头等大事,如何确保申报资料符合最新要求?合规宝实时更新办理依据,并将申报资料要求、流程及时限简洁呈现,保证您调取的都是最新要求。推荐使用行政审批事项(查看示例)。
编制产品技术资料
技术资料编写需要RA与技术人员深度沟通,指导原则是沟通基础。合规宝涵盖1000+指导原则,并与分类编码关联,即使没有针对性指导原则,也能参考同类产品要求。推荐使用技术审查指导原则。
维护注册证所需法规
维护多张注册证,即使专人监控也难免疏漏。合规宝每天检索120+信息栏目,帮您轻松获取最新法规,VIP专享法规拆解,3分钟快速了解法规内容。每月至少一次法规更新提醒,最新法规一条不漏。推荐使用现行法规汇总(免费体验)。
产品是否豁免临床
豁免临床试验将大大缩短产品注册时间,您的产品在该目录吗?合规宝完整收录已公布1400+产品数据,您可通过产品描述进行检索,结果获取更便捷。推荐使用第二类、三类、IVD试剂免临床目录。
临床基地&研究者甄选
临床试验真实性、合规性与所选基地&研究者密不可分。确保您在具备资质的临床试验机构选择对应科室及PI资质。推荐使用医疗器械临床试验机构目录。
临床试验方案编写
方案编写最重要,法规参考不能少。临床法规和技术指导原则是保证方案合规性和科学性的重要依据,合规宝不仅可以筛选临床法规,还提供数10种精确查询条件。推荐使用现行法规汇总(免费体验)和技术审查指导原则。
临床备案、人遗审批、高风险试验审批
开展临床试验之前还有重重关卡,备案、审批遗漏一小步,项目进度落后一大步。合规宝采取地毯式排查,将法规内容进行收集整理:申报要求、资料全部列明,保证查看内容“全”“新”。推荐使用行政审批事项(查看示例)。

注册质量体系核查,GMP质量体系认证
多数器械是“先注册后生产”,但境内、境外III类器械注册阶段就面临体系核查。合规宝整合体系核查所需法规依据、申报资料要求、流程及时限。推荐使用行政审批事项(查看示例)、现行法规汇总、强制性国、行标公开系统。
监督检查、飞行检查应对
最近监督检查侧重哪些方面?同类产品发现了哪些缺陷项?合规宝汇集器械境内外GMP\GSP检查数据,帮您掌握执法尺度,应对有备无患。推荐使用境内、境外飞检处罚案例库。
生产、经营质量持续合规
不但要保证公司内部体系正常运转,还要时刻关注监管要求变化。合规宝及时为您推送生产、经营环节的最新法规要求,减轻您的工作压力。推荐使用生产、经营重点监管目录,现行法规汇总(免费体验)。
不良事件监控与召回
同类产品的抽检结果、不良事件及召回信息是QA的重要参考。合规宝为您收录了8000+产品监督抽验结果,使用产品名或不合格项均可检索。推荐使用国家质量公告、不良事件信息。

产品是药械组合?是器械?是几类?
产品研发阶段不确定性最高,一些新元素的引入或适用范围的扩充很有可能改变产品的分类,或属性,新产品能不能按照医疗器械进行申报,应该按照几类申报都成了问题。推荐使用器械分类目录,试剂分类目录,目录外产品界定汇总。
创新、优先、应急审批申请
“创新驱动发展”落实到器械行业便是监管机关为临床急需且国内首创产品提供的多条绿色通道,汇集优先审评审批,专人沟通等多种加速形式。从事创新研发必须了解,推荐使用创新医疗器械特别审批申请,优先及应急审批申请。
研发阶段法规参考
研发成果能否顺利转化、快速上市,很大程度上取决于研发资料是否能支持注册申报,所以越来越多的研发人员需要持续追踪法规。合规宝作为医疗器械法规专业数据库,帮您节省宝贵时间。推荐使用现行法规汇总(免费体验)。
编制产品安全性、有效性申报资料
研发人员在产品注册申报阶段,需要提供完整的安全性、有效性证据,审评发补阶段更少不了对技术资料的发难,合规宝汇集了450+《审评技术指导原则》作为研发及申报阶段的重要参考,推荐使用注册技术审查指导原则数据库。
17
2025/12
16
2025/12
12
2025/12
10
2025/12
04
2025/12
03
2025/12
02
2025/12
27
2025/11
26
2025/11
30
2022/03
14
2022/02
09
2022/02
07
2022/02
17
2022/01
10
2022/01
24
2021/12
09
2021/12
03
2021/12
17
2025/12
16
2025/12
12
2025/12
10
2025/12
04
2025/12
03
2025/12
02
2025/12
27
2025/11
26
2025/11
15
2025/08
15
2025/07
01
2025/07
18
2025/06
28
2025/05
23
2025/05
12
2025/05
16
2025/04
27
2025/03
19
2025/02
11
2025/02
15
2024/10
10
2024/05
25
2022/10
21
2022/09
24
2022/08
02
2022/08
02
2022/08
VIEW MORE
限100字以内
限100字以内





